.png)
.png)
.png)
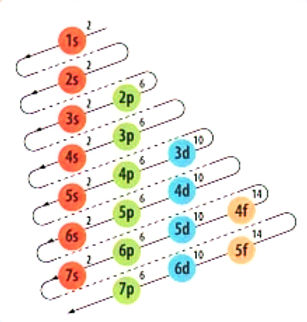
distribuición electrónica
Es la distribución de los electrones de un átomo en los diferentes estados energéticos determinados por los orbitales en dicho átomo. Así, mediante la configuración electrónica se representan los diferentes estados de los electrones presentes en el átomo.
.png)
-
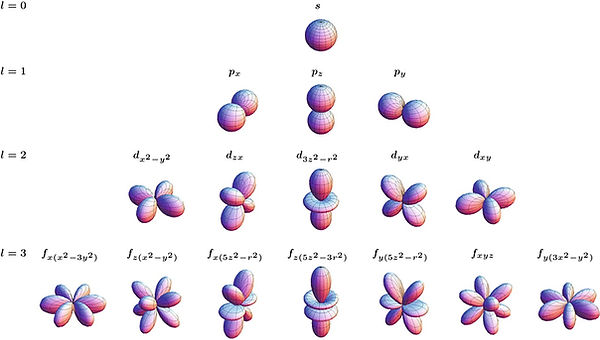
Orbitales:
Los subniveles contienen orbitales, que son regiones del espacio donde hay mayor probabilidad de encontrar un electrón. Un orbital s puede contener 2 electrones, un p 6, un d 10 y un f 14.
-
Principio de Aufbau:
Los electrones se llenan primero en los orbitales de menor energía (los más cercanos al núcleo).
-
Principio de Exclusión de Pauli:
Un orbital solo puede contener un máximo de dos electrones con spines opuestos.
-
Regla de Hund:
Los electrones se distribuyen en los orbitales de un subnivel de manera que se maximice el número de electrones con espines paralelos (no apareados).
-
Electrones de Valencia:
Son los electrones en el nivel de energía más externo, y son los que participan en los enlaces químicos.
-
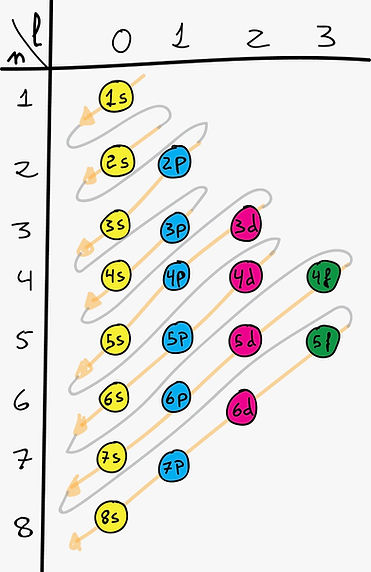
Niveles y Subniveles de Energía:
Los electrones se organizan en niveles de energía (n=1, 2, 3...) y cada nivel se subdivide en subniveles (s, p, d, f).
.png)
.png)
Ejemplos:
-
Hidrógeno (H): 1s¹ (un electrón en el orbital 1s).
-
Helio (He): 1s² (dos electrones en el orbital 1s).
-
Oxígeno (O): 1s² 2s² 2p⁴ (dos electrones en el orbital 1s, dos en el 2s y cuatro en el 2p).
.png)
.png)